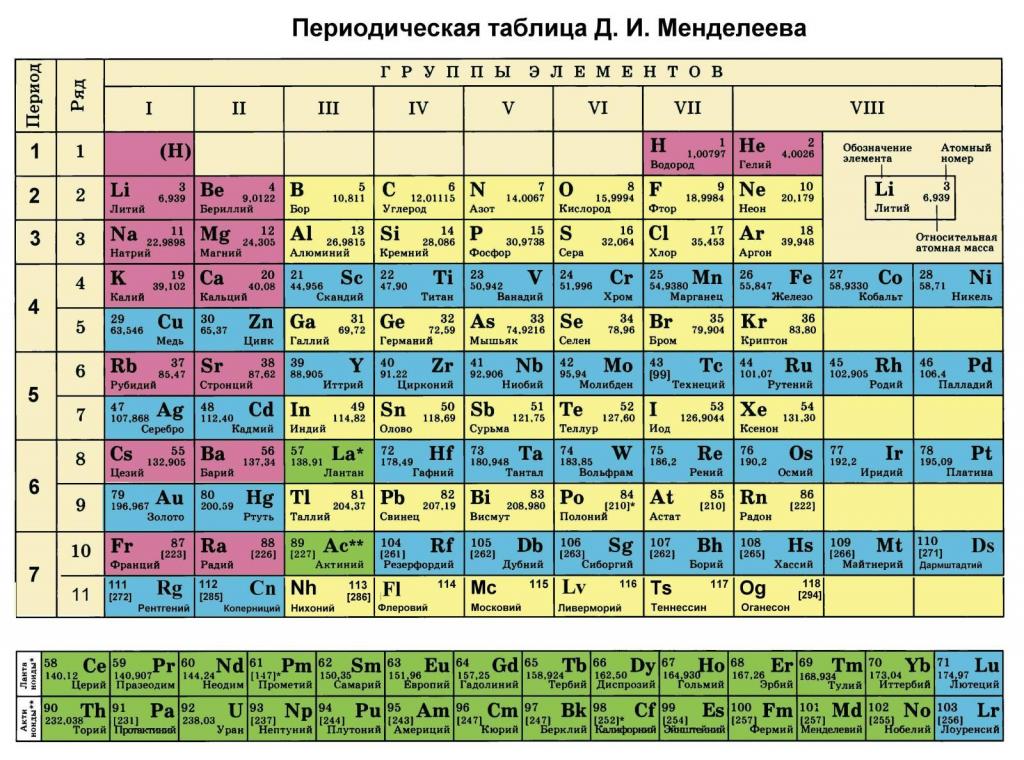
Таблица Менделеева, или также известная как периодическая система химических элементов, является одним из основополагающих инструментов в химии. Она представляет собой удобный и систематичный способ организации всех известных научных элементов в химии. История возникновения таблицы Менделеева начинается с работы русского химика Дмитрия Ивановича Менделеева в середине XIX века.
Дмитрий Иванович Менделеев впервые представил свою таблицу в 1869 году. Его задачей была систематизация знаний о химических элементах и выявление связей между ними. Менделеев стал первым ученым, который осознал, что химические элементы имеют закономерности в своих свойствах и могут быть упорядочены в логическую систему. Он создал таблицу, в которой он расположил элементы по восходящей атомной массе и группировал их по сходству свойств. Это позволило ему предсказывать свойства неизвестных элементов и заполнить пробелы в таблице.
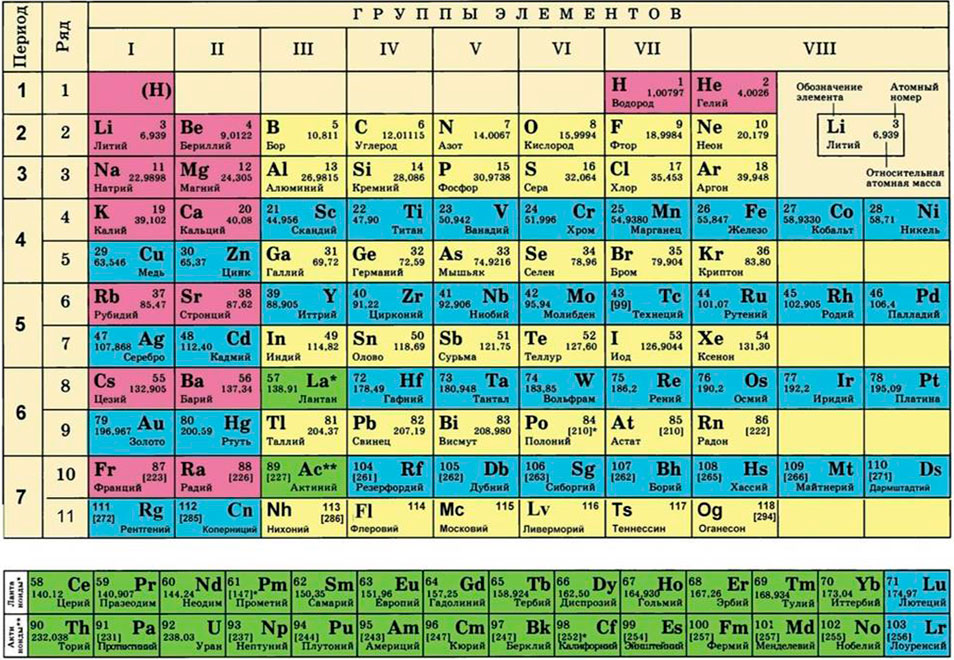
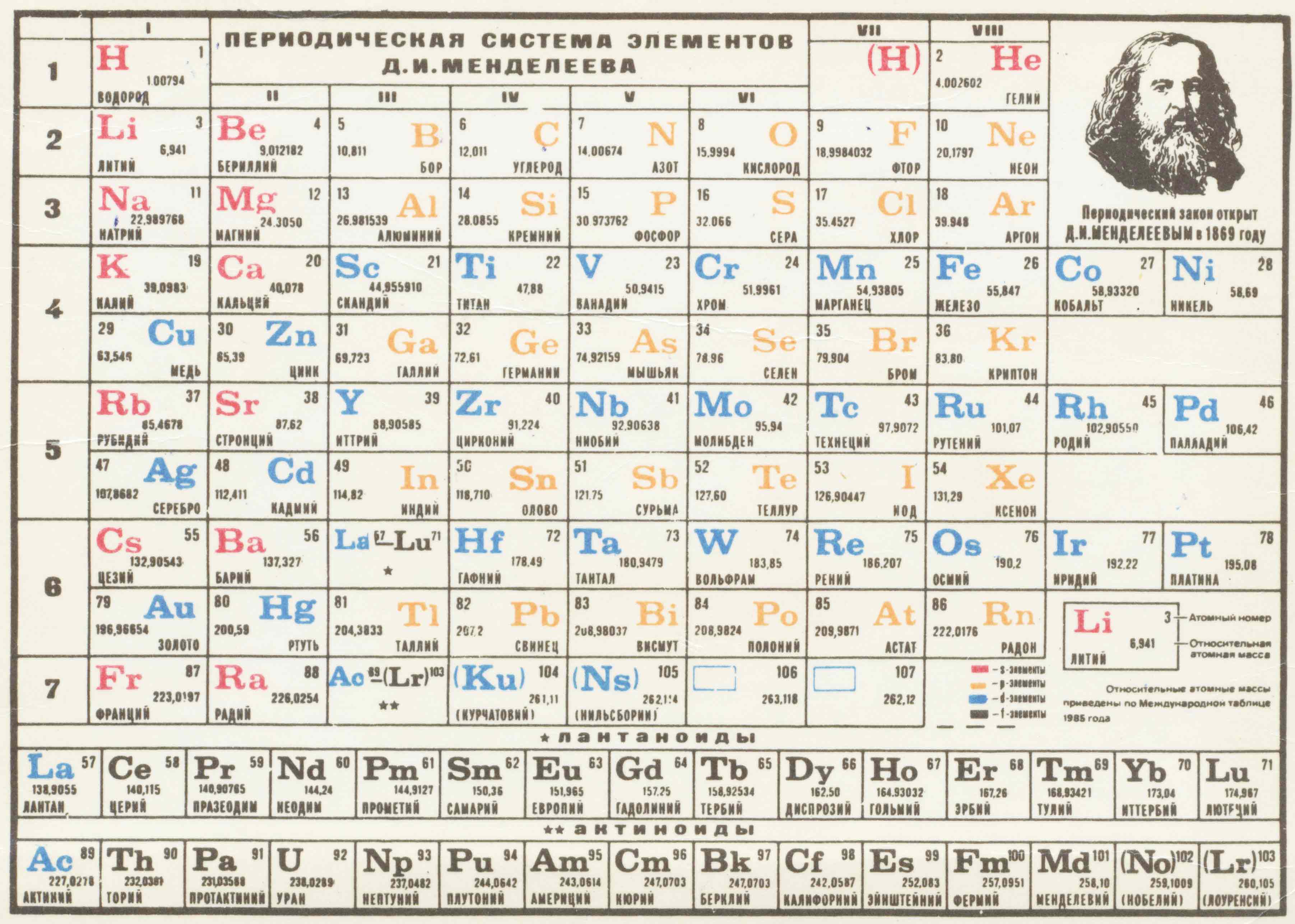
После возникновения таблицы Менделеева она была постепенно изменена и доработана другими учеными. Были добавлены новые элементы, изменены и расширены данные о свойствах уже известных элементов. В настоящее время таблица Менделеева состоит из 118 элементов, упорядоченных в 7 периодов и 18 групп. Она является неотъемлемой частью обучения химии и оказывает значительное влияние на развитие науки и технологий.
История создания таблицы Менделеева
Таблица Менделеева – это систематический способ организации химических элементов, предложенный российским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Идея создания такой таблицы возникла в результате наблюдений и систематизации большого количества данных о свойствах и характеристиках химических элементов, собранных учеными на протяжении веков.
В основу своей таблицы Менделеев положил основной принцип, согласно которому химические элементы группируются в соответствии с их атомным номером, массовым числом и химической активностью. Он расположил элементы в порядке возрастания атомных чисел, при этом уделяя особое внимание свойствам каждого элемента и его аналогов.
Первая версия таблицы Менделеева состояла из 63 элементов и была опубликована в 1869 году. Однако со временем были открыты новые элементы, и таблица продолжала развиваться и совершенствоваться. В 1913 году таблица была дополнена построением новых рядов элементов и систематическими изменениями в строении таблицы.
Таблица Менделеева стала основой для классификации и систематизации элементов, а также для предсказания свойств новых элементов, которые еще не были открыты. Она стала основой для дальнейших исследований и разработок в области химии и физики элементов. Сегодня таблица Менделеева – это не только базовый инструмент в науке, но и важнейшая часть образования в области химии.
Открытие первых элементов
Медь (Cu) была одним из первых элементов, открытых человеком. Еще в древности люди заметили, что медную руду можно нагреть и получить мягкий, пластичный металл. Уже в V тысячелетии до н.э. медь использовалась для изготовления украшений, оружия и посуды.
Свинец (Pb) также относится к первым открытым элементам. Свинец был известен древним цивилизациям и использовался для изготовления различных предметов, включая водосточные трубы, печатные шрифты и легкие сплавы.
Сера (S) была одним из элементов, которые люди начали извлекать из земли уже в древности. Используя серу, люди создавали различные соединения и применяли их в медицине, косметике и производстве красителей.
Углерод (C) также был открыт еще в древности. Человек заметил, что древесина горит огнем и превращается в уголь, и уголь можно использовать для нагрева и пищевой поддержки. Углерод был использован для создания чернил, красителей и других веществ.
Золото (Au) относится к драгоценным металлам, которые были открыты и использованы человеком в разные эпохи и культуры. Золото было известно египтянам, грекам и другим древним цивилизациям. Оно использовалось для изготовления украшений, денег и религиозных предметов.
Открытие водорода
Открытие водорода было одним из важных моментов в развитии химии. Водород — это самый легкий элемент в периодической системе элементов, состоящий из одного протона и одного электрона. История открытия водорода начинается в конце XVII века, когда во время опытов с кислотами и металлическими металлами ученые заметили появление газообразного вещества при их взаимодействии.
Первым ученым, который дал определение водорода, был английский химик Генри Кавендиш в 1766 году. Он изолировал водород, проводя электрический ток через воду, и назвал его «воспламеняемым воздухом». Кавендиш также провел серию опытов и установил, что водород обладает низкой плотностью и способен сгорать в присутствии кислорода, образуя воду.
Открытие водорода имело большое значение для дальнейшего развития химии. Водород стал широко использоваться в различных отраслях промышленности — от производства синтетических удобрений до ракетных двигателей. Он также нашел применение в химических реакциях, таких как восстановление веществ и синтез органических соединений.
Важно отметить, что водород является ключевым компонентом в процессе ядерного синтеза, который происходит в звездах, в том числе и в Солнце. Понимание свойств и химических реакций водорода открыло новые горизонты в нашем понимании Вселенной и основ термоядерной энергетики.
Открытие кислорода
Открытие кислорода стало важным шагом в развитии химической науки. Кислород был открыт в конце XVIII века независимо несколькими учеными. Само открытие было произведено благодаря развитию новых техник и методов.
Одним из первых ученых, кто открыл кислород, был шведский химик Карл Шееле. В 1772 году он провел опыты с использованием оксида меди и хлората серебра, получив новый газ, который он назвал «воздухом флогистона». Однако Шееле не удосужился продолжить исследования, чтобы полностью понять свойство этого газа.
Затем, в 1774 году, Антуан Лавуазье, французский химик, второй раз открыл кислород независимо от Шееле. Он провел серию опытов, используя различные химические соединения, и обнаружил, что воздух состоит преимущественно из кислорода и азота. Лавуазье предложил название «кислород» для этого нового газа.
Открытие кислорода стало ключевым моментом в понимании процессов сгорания и дыхания. Кислород оказался необходимым для поддержания жизни и поддержания горения. Эта находка стала отправной точкой для создания таблицы Менделеева и развития химической науки в целом.
Вклад прежних ученых
Таблица Менделеева является результатом синтеза множества научных открытий и исследований, проведенных прежними учеными. Этот значимый инструмент современной химии был отшлифован и совершенствовался на протяжении многих веков. На его создание повлияли такие имена, как Лавуазье, Пристли, Берцелиус, Дальтон и многие другие.
Прежние ученые проводили множество экспериментов, анализируя реакции различных элементов и соединений. Например, Лавуазье изучал процессы горения и доказал, что вещество при горении соединяется с кислородом. Пристли исследовал определенные газы, показывая их взаимодействие с другими элементами. Берцелиус изучал силу тока в электролитических ячейках, что позволило ему провести точную определение атомных масс элементов.
Исследования этих ученых вели к открытию и систематизации химических элементов. Они выделили основные свойства и химические реакции элементов, что послужило основой для последующего создания таблицы Менделеева. Был разработан уникальный способ классификации элементов, основанный на их атомной массе и химических свойствах. Это позволило ученым систематизировать и организовать знания о химических элементах в логическую структуру, которую мы сегодня называем таблицей Менделеева.
Благодаря вкладу прежних ученых, таблица Менделеева стала важнейшим инструментом в химии. Она позволяет ученым легко находить и сравнивать свойства элементов, предвидеть их реакции и использовать их в различных научных и практических областях. Внедрение этой таблицы стало революцией в химии и оказало огромное влияние на ее развитие как науки.
Теории Лейвеница
![]()
В истории развития таблицы Менделеева большую роль сыграли теории российского химика Лейвеница. Он предложил несколько гипотез, которые послужили основой для классификации химических элементов.
Одной из основных теорий Лейвеница была гипотеза о дополнительности химических элементов. Он предполагал, что в природе существуют независимые элементы, которые еще не были открыты, но необходимы для полной симметричной систематизации. Эта идея позволяла предположить пропущенные элементы и предсказать их химические свойства.
Еще одной важной гипотезой Лейвеница была теория трех периодов. Он предполагал, что элементы в таблице Менделеева расположены в порядке возрастания атомного веса и разделены на три периода. Первый период состоит из 2 элементов, второй период — из 8 элементов, а третий период — из 8 элементов. Эта теория дала возможность классифицировать элементы и предсказывать их свойства в каждом периоде.
Главным достижением Лейвеница стала его таблица классификации химических элементов. Она подразделяла все элементы на группы по их химическим свойствам и атомным весам. Благодаря этой таблице, ученые смогли прогнозировать свойства отсутствующих элементов и искать их в природе.
Исследования Мейстера
Одним из значимых вкладов в развитие таблицы Менделеева внес Фридрих Мейстер. В работе «Университетская наука о недостаточном и вредном питании» он изучал химический состав различных продуктов и веществ, а также влияние недостаточного и вредного питания на организм человека.
Мейстер разработал методику анализа веществ, основанную на определении их химического состава. Он классифицировал вещества по признакам и определял их атомные массы. Благодаря своим исследованиям, он смог установить зависимость между химическим составом веществ и их физическими и биологическими свойствами.
Мейстер также создал свою собственную таблицу элементов, в которой указывал атомные массы и химические свойства различных веществ. Однако, его таблица не была достаточно систематизированной и не получила широкого признания.
Тем не менее, исследования Мейстера оказали значительное влияние на развитие химии и таблицы Менделеева. Сегодня его работы рассматриваются как важный этап в истории формирования и развития периодической системы элементов.
Расстановка элементов

В таблице Менделеева элементы расположены по порядку возрастания их атомной номера, который определяется числом протонов в ядре атома. Первым элементом таблицы является водород (H) с атомным номером 1, затем идет гелий (He) с атомным номером 2 и так далее до самого тяжелого элемента, расположенного в самом нижнем правом углу таблицы.
В таблице Менделеева элементы также расположены внутри групп и периодов. Группы представляют собой вертикальные столбцы таблицы, обозначенные числами от 1 до 18. Периоды представляют собой горизонтальные ряды элементов, обозначенные числами от 1 до 7. Каждый элемент в таблице сам по себе является уникальным, имеет уникальные свойства и обладает своим атомным номером.
Главное достижение Менделеева состояло в том, что он смог установить закономерности в свойствах элементов и предсказать свойства неизвестных ему элементов на основе свойств соседних элементов в таблице. Это позволило заполнить пробелы в таблице и сделать ее полностью упорядоченной.
Но таблица Менделеева не является статичной, она постоянно развивается. В настоящее время в таблицу были добавлены новые элементы, которые были синтезированы в лабораториях и получены в результате ядерных реакций. Также в таблице были внесены некоторые изменения в связи с открытием новых закономерностей и получением новых данных о свойствах элементов.
Первые попытки систематизации
История таблицы Менделеева началась в XIX веке, когда химики активно исследовали различные элементы и составы веществ. На протяжении многих лет не было единой системы классификации химических элементов, и каждый химик использовал собственную схему.
Первые попытки систематизации проводились химиками Йоханом Вольфгангом Дёберейнером и Антуаном Лавуазье. Они пытались группировать элементы по их свойствам, но их системы были несовершенными и не учитывали все известные элементы.
Важную роль в развитии таблицы Менделеева сыграли работы химиков Александра Мичурина и Жан-Батиста Дюмазеля. Мичурин предложил систему классификации элементов, основанную на их атомных массах, а затем Дюмазель усовершенствовал эту систему, добавив некоторые новые элементы.
Однако самая полная и систематизированная таблица была создана Дмитрием Менделеевым в 1869 году. В своей таблице Менделеев упорядочил элементы по их атомным массам и связал их с их химическими свойствами. Он также предсказал существование ещё не открытых элементов и оставил пустые места в таблице для них.
Открытие закономерностей

Открытие закономерностей в химических свойствах элементов стало одним из ключевых моментов в развитии таблицы Менделеева. Ученые заметили, что свойства элементов периодически повторяются с определенным периодом. Это означает, что с ростом атомного номера, свойства элементов меняются и возвращаются к начальному состоянию.
Открытие закономерностей в химических свойствах позволило классифицировать элементы и установить систематику их расположения в таблице Менделеева. Ученые смогли предсказывать свойства еще не открытых элементов и даже найти пробелы в таблице, что послужило стимулом для дальнейших исследований. Благодаря этому открытию была возможна систематизация химических знаний и более глубокое понимание мира элементов.
Закономерности в химических свойствах элементов помогли установить их группы и периоды в таблице Менделеева. Элементы, находящиеся в одной группе, обладают схожими свойствами, так как имеют одно и то же количество электронов на внешнем энергетическом уровне. В то же время, элементы в одном периоде отличаются друг от друга по своим вышестоящим энергетическим уровням и могут иметь разные химические свойства.
Открытие закономерностей в химических свойствах элементов стало основой для развития современной химии и привело к созданию таблицы Менделеева. История развития таблицы Менделеева связана с работой множества ученых и их вкладом в понимание структуры и свойств элементов. Сегодня таблица Менделеева является основополагающим инструментом в изучении химии и позволяет предсказывать и понимать свойства различных веществ.