Таблица Менделеева — это уникальный инструмент, который представляет собой систематическое упорядочение известных химических элементов. Ее создание — это результат длительных исследований и обобщения знаний о химических свойствах веществ, проведенных русским ученым Дмитрием Менделеевым в середине XIX века. Изначально таблица была представлена в периодической форме, однако с течением времени она подвергалась различным изменениям и усовершенствованиям.
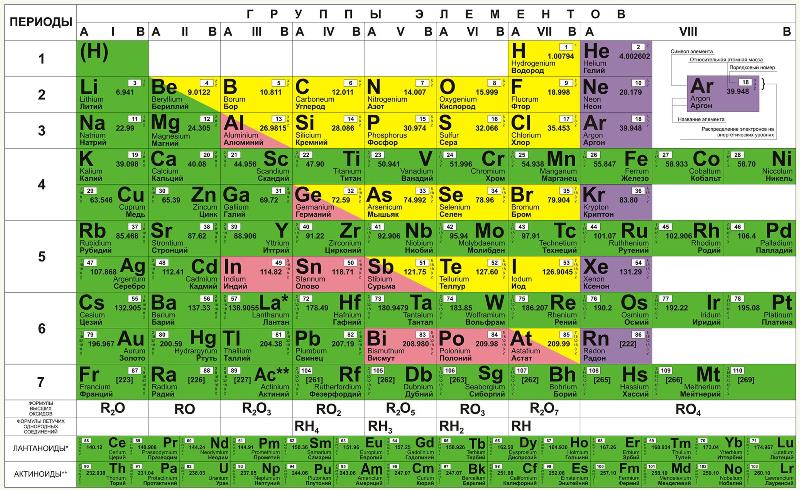
Основной принцип, лежащий в основе классификации элементов в таблице Менделеева, — это упорядочение их по возрастанию атомного номера. Атомный номер — это количество протонов в ядре атома. Такая систематизация позволяет сразу определить заряд ядра, количество электронов и другие характеристики элемента. Также таблица отражает периодичность химических свойств элементов. Создание таблицы Менделеевым стало важным шагом в развитии химии и сыграло решающую роль в понимании строения веществ и проведении дальнейших исследований.
Следует отметить, что таблица Менделеева является постоянно изменяющимся орудием, отражающим новые открытия и исследования в области химии. В настоящее время в таблице представлено 118 химических элементов, органично вписывающихся в ее структуру. Каждый элемент имеет свое место в таблице и свои характеристики, которые определяют его позицию и взаимодействие с другими элементами. Таблица Менделеева является основой для понимания и изучения свойств веществ и нашла свое применение во многих областях науки и техники.
- История формирования таблицы Менделеева
- Развитие представлений о химических элементах
- Периодический закон и его открытие
- Ранние попытки классификации элементов
- Принципы классификации в таблице Менделеева
- Тренды периодической системы
- Периоды и группы в таблице
- Свойства химических элементов
- Применение таблицы Менделеева в современной химии
- Расширение и доработка таблицы
- Открытие новых элементов
- Применение периодической системы в химических исследованиях
История формирования таблицы Менделеева
Таблица Менделеева — это систематическое представление химических элементов, разработанное русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Это одна из самых важных достижений в истории химии, которая позволяет систематизировать и классифицировать более 100 элементов, отражая их основные свойства и закономерности.
Идея создания таблицы Менделеева возникла в результате попытки найти закономерности между свойствами элементов. Менделеев основывался на знаниях о том, что существуют различные химические элементы, и пытался найти способ объединить их в систему. Он анализировал химические реакции и свойства элементов, и пытался найти закономерности, которые могли бы объяснить их поведение.
Первый вариант таблицы Менделеева был представлен в 1869 году на основе классификации элементов по их атомным весам и химическим свойствам. Он объединял элементы в вертикальные группы с похожими свойствами и горизонтальные ряды. Менделеев оставил пробелы в таблице для элементов, которые еще не были открыты, но которые должны существовать на основе закономерностей и тенденций в других элементах.
С течением времени таблица Менделеева стала основой для дальнейших открытий и развития химических наук. В последующие годы были открыты новые элементы, которые заполнили пробелы в таблице и подтвердили ее правильность и полезность. Сегодня таблица Менделеева является неотъемлемой частью учебников химии и основой для изучения и понимания химических закономерностей и свойств элементов.
Развитие представлений о химических элементах
О разнообразии веществ и их различных свойствах человек знал с древних времен, но решительный шаг к систематизации знаний в области химии был сделан лишь в XIX веке. Великий вклад в развитие представлений о химических элементах внесли такие ученые, как Антуан Лавуазье, Дмитрий Менделеев и другие.
Основоположником современной химии считается Антуан Лавуазье, который в 1789 году сформулировал закон сохранения массы в реакциях. Он предложил также первую классификацию химических элементов и внес важный вклад в развитие представлений о них.
В следующем веке Дмитрий Менделеев разработал периодическую систему химических элементов, которая основана на упорядочении элементов в порядке возрастания атомных масс. Он предложил также предсказывать свойства новых элементов и заполнять пустые ячейки в таблице. Эта система стала основополагающей в химии и функционирует до сих пор.
Современные ученые продолжают исследования в области химических элементов, и на сегодняшний день известно больше 100 элементов. Они продолжают уточнять свойства элементов и исследуют их поведение в различных условиях. Развитие представлений о химических элементах является важной составляющей развития химии в целом.
Периодический закон и его открытие
Периодический закон является одним из основных законов химии, который описывает систематическое повторение химических и физических свойств элементов. Открытие этого закона играло ключевую роль в развитии науки о химических элементах.
Открытие периодического закона связано с именами Дмитрия Менделеева и Жана-Батиста Джеббера. В 1869 году Менделеев предложил систематическое расположение элементов в таблице, называемой Таблицей Менделеева. Он упорядочил элементы по возрастанию их атомных масс и обратил внимание на повторение свойств элементов через определенные периоды.
Основным принципом периодического закона является то, что химические и физические свойства элементов периодически повторяются в определенных промежутках времени, которые называются периодами. Кроме того, эти свойства систематически изменяются вдоль периодов и в зависимости от атомной структуры элементов.
Периодический закон позволяет классифицировать и систематизировать элементы и предсказывать их свойства на основе их положения в таблице. Это позволяет ученым изучать и понимать химическую реакцию, взаимодействие элементов и создавать новые вещества с желаемыми свойствами.
Открытие периодического закона имело огромное значение для развития химии и позволило сделать большой шаг вперед в понимании и изучении свойств химических элементов. Сегодня Таблица Менделеева является основой для изучения химических элементов и приложений во многих областях науки и техники.
Ранние попытки классификации элементов
Идея классифицировать элементы их химическими свойствами возникла задолго до создания Таблицы Менделеева. В древние времена ученые уже пытались разделить элементы на группы, но их попытки были недостаточно систематичными и не привели к созданию единой классификации.
В XVI веке алхимики начали использовать термины «металлы» и «неметаллы» для описания химических элементов. Однако такое деление было достаточно грубым и не учитывало все разнообразие элементов.
В XVIII веке ученые стали активно исследовать и изучать химические реакции и свойства элементов. Классификация элементов стала более основанной на опыте. Шведский химик Торберн Бергман в 1775 году предложил разделить элементы на металлы, неметаллы и полуметаллы. Однако и эта классификация была несовершенной и не позволяла полностью систематизировать элементы.
Только в XIX веке, благодаря работам ряда ученых, удалось создать более точную классификацию химических элементов. Важную роль в этом процессе сыграл российский ученый Дмитрий Менделеев, который в 1869 году представил первый вариант Таблицы Менделеева, основанной на систематическом расположении элементов по возрастанию их атомных масс.
Принципы классификации в таблице Менделеева
Таблица Менделеева — это основной инструмент в химии, который позволяет организовать и классифицировать информацию о химических элементах. Существуют определенные принципы, которые легли в основу классификации элементов в таблице Менделеева.
Первый принцип классификации основан на атомном номере элемента — количество протонов в ядре атома. Атомный номер постоянен для каждого элемента и увеличивается по мере продвижения слева направо и сверху вниз в таблице. Таким образом, элементы расположены в порядке возрастания атомного номера.
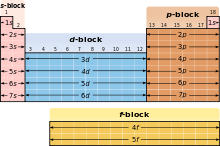
Второй принцип классификации основан на расположении элементов внутри блоков. Такие блоки, как s-блок, p-блок, d-блок и f-блок, отражают электронную конфигурацию атомов элементов. Блок s включает первые два столбца таблицы, блок p — последующие шесть столбцов, блок d — следующие 10 столбцов, и блок f — последние 14 столбцов. Расположение элементов в блоках позволяет выделить их характеристики.
Третий принцип классификации основан на периодах — горизонтальных рядах элементов в таблице. Каждый горизонтальный ряд соответствует одному энергетическому уровню, на котором располагаются электроны атомов элементов. Каждый следующий ряд имеет большее количество энергетических уровней, что отражается в увеличении размера и сложности атомов в таблице.
Таким образом, принципы классификации в таблице Менделеева — это основа для упорядочивания и систематизации информации о различных химических элементах, позволяя установить связи между ними и изучать их свойства и взаимодействия.
Тренды периодической системы
Периодическая система химических элементов является основным инструментом для систематизации и классификации химических элементов. В рамках этой системы можно выделить несколько трендов, которые помогают увидеть закономерности в свойствах и характеристиках элементов.
-
Атомные радиусы:
Атомный радиус является одним из основных параметров, отражающих размер атома. В периодической системе атомные радиусы элементов увеличиваются при движении слева направо по периоду и уменьшаются при движении сверху вниз по группе. Таким образом, можно заметить, что атомные радиусы элементов возрастают при переходе от верхнего левого угла таблицы Менделеева к нижнему правому углу.
-
Ионные радиусы:
Ионный радиус представляет собой размер иона, который может быть положительным или отрицательным. Он также демонстрирует тренды в периодической системе. Обычно ионные радиусы увеличиваются при движении слева направо по периоду и увеличиваются при движении сверху вниз по группе.
-
Электроотрицательность:
Электроотрицательность элемента – это его способность притягивать электроны в химической связи. В таблице Менделеева электроотрицательность элементов увеличивается при движении слева направо по периоду и уменьшается при движении сверху вниз по группе.
-
Энергия ионизации:
Энергия ионизации – это энергия, необходимая для удаления электрона из атома. В периодической системе энергия ионизации обычно увеличивается при движении слева направо по периоду и уменьшается при движении сверху вниз по группе.
-
Электроотрицательность:
Металлические свойства элементов уменьшаются при движении слева направо по периоду и увеличиваются при движении сверху вниз по группе. Неметаллические свойства, наоборот, увеличиваются при движении слева направо и уменьшаются при движении сверху вниз.
Периоды и группы в таблице
Таблица Менделеева представляет собой систематическое упорядочение элементов, основанное на их атомных свойствах. Одним из основных принципов классификации в таблице является разделение элементов на периоды и группы.
Периоды — это горизонтальные строки таблицы, которые указывают на количество электронных оболочек у атомов элементов. Периоды пронумерованы от 1 до 7 сверху вниз. Каждый последующий период начинается с новой электронной оболочки и может содержать больше элементов, чем предыдущий.
Группы — это вертикальные столбцы таблицы, которые указывают на количество валентных электронов в атомах элементов. Группы также пронумерованы и обозначаются числами от 1 до 18. Первые две группы — с учетом валентных электронов — являются группами щелочных металлов и щелочноземельных металлов соответственно.
Внутри группы элементы имеют схожие свойства, так как обладают одинаковым количеством валентных электронов. Отличия между элементами внутри группы заключаются в размере и форме атома, а также в силе взаимодействия с другими элементами.
Расположение элементов в таблице Менделеева по периодам и группам позволяет увидеть закономерности и тренды в изменении свойств элементов по мере движения по периоду или группе. Это помогает в понимании химического поведения и свойств элементов, а также имеет практическое значение для многочисленных применений элементов в различных областях науки и технологии.
Свойства химических элементов
Химические элементы отличаются по своим свойствам, которые определяют их поведение в химических реакциях и взаимодействие с другими веществами. Одним из основных свойств элементов является атомная масса, которая указывает на количество протонов и нейтронов в ядре атома. Чем выше атомная масса элемента, тем больше атомы этого элемента могут содержать протонов и нейтронов в ядре.
Кроме атомной массы, элементы имеют также определенные электронные свойства. Все элементы имеют определенное количество электронов во внешней оболочке, которое определяет их химическую активность. Элементы с неполной внешней оболочкой стремятся принять или отдать электроны, чтобы достичь стабильной конфигурации. Это явление называется химической реактивностью.
Следующим важным свойством элементов является электроотрицательность — способность атома атома притягивать электроны к себе в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны и образует полярную химическую связь с другими элементами. Электроотрицательность позволяет предсказать тип связей, образующихся между элементами, а также их реакционную способность.
Кроме перечисленных свойств, элементы также имеют определенные физические свойства, такие как плотность, температура плавления и кипения, теплопроводность и электропроводность. Эти свойства определяют состояние вещества при данной температуре и давлении и влияют на множество его физических и химических свойств.
Применение таблицы Менделеева в современной химии
Таблица Менделеева является фундаментальным инструментом в современной химии. Она представляет собой организацию химических элементов в стройную систему, обладающую определенными закономерностями и принципами. Благодаря таблице Менделеева химики могут классифицировать элементы, понимать их свойства и совершать открытия новых веществ.
Классификация элементов по таблице Менделеева основана на их атомном строении и свойствах. Элементы располагаются в порядке возрастания атомного номера, а в одной горизонтали (периоде) таблицы находятся элементы с одинаковым количеством электронных оболочек. Вертикальные столбцы (группы) соответствуют элементам с аналогичной структурой электронных оболочек и свойствами.
С помощью таблицы Менделеева химики смогли предсказать свойства новых элементов, которые позже были открыты и получили свои места в таблице. Также благодаря таблице Менделеева можно обнаружить закономерности в свойствах элементов, такие как размер атома, электроотрицательность, химическая активность и другие. Эти закономерности помогают установить взаимосвязь между различными элементами и прогнозировать их свойства.
Другим важным применением таблицы Менделеева является использование ее для составления химических уравнений и описания химических реакций. Зная положение элементов в таблице и их свойства, химики могут предсказать, какие элементы смогут образовать стабильные соединения или взаимодействовать с другими веществами.
Расширение и доработка таблицы
С течением времени таблица Менделеева была расширена и доработана, чтобы отражать все большее число химических элементов и их свойств. Вначале таблица содержала только несколько десятков элементов, но с каждым открытием нового элемента она пополнялась и становилась все более объемной и разнообразной.
Одной из важных доработок таблицы было расширение по горизонтали. Классификация элементов по группам и периодам позволила упорядочить их и систематизировать. Группы представлены вертикальными столбцами, а периоды — горизонтальными рядами. Такая структура облегчает поиск и анализ информации о каждом элементе.
Кроме того, в таблицу были введены новые химические элементы, открытые в результате научных исследований и экспериментов. Каждый новый элемент получил свое уникальное место в таблице в соответствии с его атомным номером и химическими свойствами. Новые элементы представлены символами и характеристиками, чтобы облегчить их изучение и понимание.
Открытие новых элементов
Систематическое изучение химических свойств элементов привело к открытию новых элементов в таблице Менделеева. Впервые это произошло в 1808 году, когда Эрстед изолировал элемент стронций из минерала струнцианита. В дальнейшем были открыты множество других элементов, включая ксенон, при анализе газов воздуха.
Для открытия новых элементов необходимы сложные химические эксперименты и анализ данных. Ученые проводят спектрометрические и кристаллографические исследования, чтобы определить состав и структуру новых веществ. Также существуют методы, позволяющие создавать искусственные элементы, синтезированные в лаборатории.
Открытие новых элементов вносит значительные изменения в таблицу Менделеева. Добавление новых элементов расширяет нашу понимание о химических свойствах и закономерностях веществ. Новые элементы могут иметь своеобразные свойства и создавать новые соединения, что позволяет нам исследовать их применение в различных областях науки и технологии.
Применение периодической системы в химических исследованиях
Периодическая система Дмитрия Менделеева является основополагающей схемой для организации и классификации химических элементов. Она играет ключевую роль в химических исследованиях, позволяя ученым систематизировать знания о различных элементах и их свойствах.
В химических исследованиях периодическая система используется для анализа взаимодействия элементов, предсказания их химических свойств и поведения. Благодаря эффективной организации элементов по группам и периодам, ученые могут обнаруживать закономерности и устанавливать связи между их свойствами.
Периодическая система позволяет:
- Определить особенности химического строения и свойств элементов;
- Сделать прогнозы о реакционной способности элементов;
- Исследовать химические реакции и их условия;
- Определить требования для синтеза новых соединений;
- Установить связь между атомарной структурой и физическими свойствами элементов;
- Провести анализ и классификацию материалов на основе их состава и свойств.
Периодическая система является незаменимым инструментом для химиков и исследователей во всем мире. Множество открытий и научных открытий были сделаны благодаря пониманию и применению этой системы. Она позволяет систематизировать знания, упрощает химические расчеты и открывает новые возможности для развития химической науки и технологий.